
2018-12-17
李慧博
肝胆相照
李慧博
肝胆相照
A+
A-
原研药是指经过对有活性的化合物进行筛选和严格的临床前和临床研究才被批准上市的原创性新药。仿制药是指与原研药具有相同的活性成分、剂型、剂量、规格和使用途径,可以在形状、释放机制、赋形剂、包装和有效期等方面有所不同的替代药品。由于节省了大量的研发成本,仿制药的价格与原研药相比具有巨大的价格优势,使其在临床使用降低了医疗支出,提高了药品的可及性,提升医疗服务水平,具有重要的经济和社会效益[1-3]。
然而,原研药和仿制药的区别并非只是价格方面,对于医生、药师和患者而言,都格外关注疗效及安全性方面的差异。我国是肝病大国,2018年《柳叶刀》子刊发布的数据显示,中国目前乙肝表面抗原的阳性率为6.1%,推算我国目前8600万乙肝病毒感染者。恩替卡韦是治疗慢性乙型肝炎的一线药物也是目前市场份额较高的药物。本文将仿制药的发展和我国最新仿制药一致性评价的相关政策情况进行了解读,以及以恩替卡韦为例,将其仿制药的质量再评价的研究结合仿制药一致性评价中的关键指标进行了总结和分析。
一、仿制药一致性的内涵
世界卫生组织( WHO)在教育公众接受仿制药、增加药物可及性、降低药品支付负担时,将仿制药描述为是可与原研药相互替换的药品,一般而言,在原研药的专利过期或市场独占期结束后,仿制药厂即可在不经原研药厂许可的条件下生产[4, 5]。然而仿制药在上市前缺乏足够有力的临床数据,使得大部分仿制药与原研药在临床疗效方面是有区别的。美国FDA颁布的《橙皮书》中规定[5],治疗相等的仿制药要满足以下5条总体原则:①与原研产品具有一样的安全性和有效性(therapeutic equivalence,TE)。②药学等效(pharmaceutical equivalence,PE),即制药或化学等效,即同等化学纯度条件下,活性成份具有相同强度和相同剂量。③生物等效(bioequivalence,BE),即药物的化学成份一致,且具有相似的吸收速度和程度。④适当的说明书。⑤按照GMP的要求组织生产。首先,应是以GMP为代表的一系列与药品、辅料、制剂的制备、合成等生产、验证、质控方面合规性的一致性。其后,是制剂在处方、剂型、 规格、剂量的药学一致。再后,是以生物等效去验证。经过验证的在BE方法学上无技术问题的理论上判定为治疗等效。最后,仿制药的说明书与原研产品在治疗上可相互替换。PE、BE、TE是仿制药一致性的3个层次,BE不等同于TE,TE则需要进一步的临床对比研究以获得可靠的数据。不同国家和地区的药品监管立法虽有不同,但都将前述五层一致性要件作为技术策略的核心。五层一致性要素可以按图1的递进阶梯图表呈现。
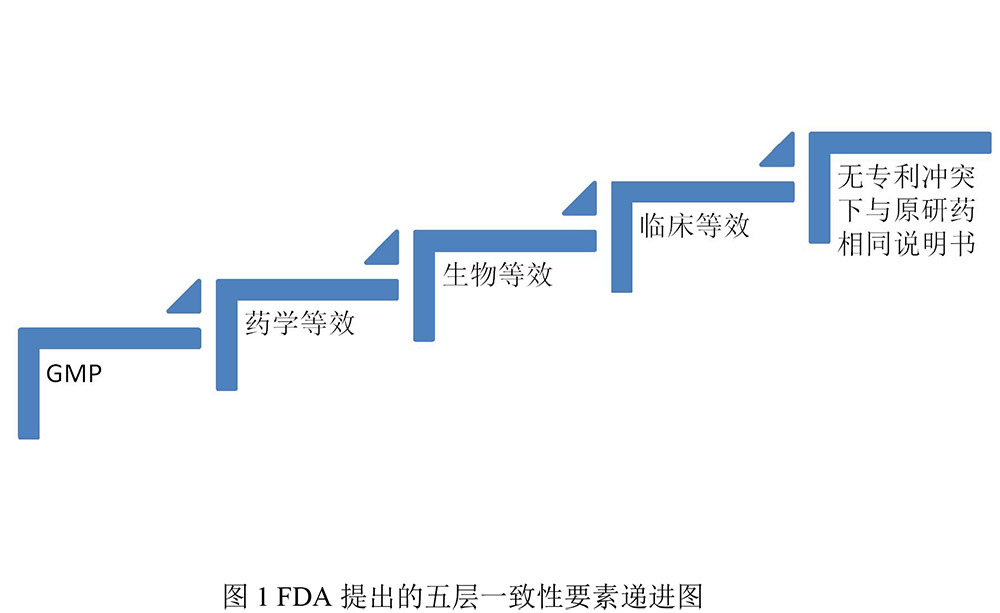
一项关于国内仿制药与原研药临床疗效对比的研究发现,在癫痫、帕金森、精神疾病、器官移植、心血管和感染疾病方面的相比两者存在一定差异[1]。尽管仿制药与原研药的活性物质相同,但是由于受制剂学、GMP与药品质量、生物等效性参照药品及要求、生物等效性试验受试人群、药物治疗窗等的差异等因素的影响,导致了仿制药与原研药疗效的差异[1]。
二、仿制药一致性评价国内现状
中国仿制药一致性评价的发展阶段可根据国家颁布的政策以及政策实施情况分为2个阶段。第一阶段为2012~2014年,为前期探索阶段;第二阶段是从2015年至今,为迅速发展阶段。从2012年开始,为落实国家药品安全“十二五”规划,提高仿制药质量,国家食品药品监督管理局发布了《关于开展仿制药质量一致性评价工作的通知(国食药监注[2013]34 号)》。随后中国食品药品检定研究院成立了仿制药质量一致性评价项目办公室负责仿制药一致性评价工作的开展。这一阶段,虽然国家出台了一些政策促进仿制药一致性评价的开展,但并未对一致性评价的具体方式及时限等细节问题进行说明,因此制药企业没有积极参与其中,收效甚微,最后停滞不前。
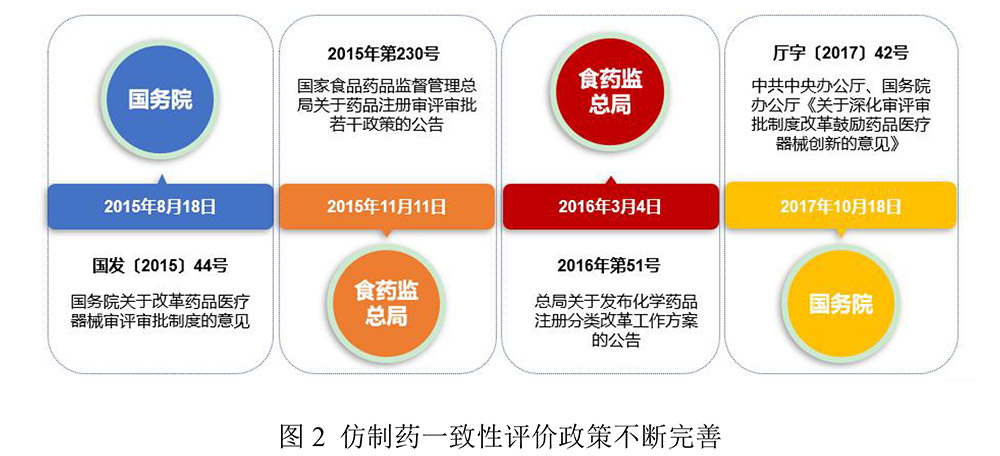
我国自2015年开始,拉开了药品审评审批改革大幕,将仿制药由现行的“仿已有国家标准的药品”调整为“仿与原研药品质量和疗效一致的药品”,其审评审批要以原研药作为参比制剂。对于市场上存量巨大的已上市仿制药,按照与原研药质量和生物等效性一致的原则,分期分批进行一致性评价。要求化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。此外,化学药品新注册分类方案实施后,新注册3类(境内申请人仿制境外上市但境内未上市原研药品的药品)、4类(境内申请人仿制已在境内上市原研药品的药品)仿制药要求该类药品应与原研药品的质量和疗效一致。我国仿制药一致性评价政策在不断完善见图2。凡纳入与原研药可相互替代药品目录即《中国上市药品目录集》的仿制药,可使用“通过一致性评价”标识。通过一致性评价的药品,在临床使用和医保支付方面给予政策上的支持。
仿制药以原研药为对照进行生物等效性对比研究,在80%~125%之内可认为两者具有生物等效性。对于复杂的患者人群,以健康受试者为研究对象的生物等效性研究无法完全替代临床患者的药代动力学特征。因此,随机大样本的“头对头”临床试验对于评估仿制药与原研药是否治疗等效具有重要意义。
三、恩替卡韦的一致性评价
恩替卡韦是目前WHO以及我国指南推荐的慢性乙型肝炎患者抗病毒治疗的一线药物之一[6, 7]。恩替卡韦为强效的口服鸟嘌呤核苷类似物,能够选择性抑制 HBV复制,可在细胞内磷酸化成具有活性的三磷酸盐,并与HBV逆转录酶天然底物三磷酸脱氧鸟嘌呤核苷竞争而产生药效。
恩替卡韦分散片(润众®,正大天晴药业集团股份有限公司)于2010年2月在国内首家获得原料和制剂批件并上市。润众®针对原研药的专利封锁开展诸多重大创新,先后有7项发明专利授权(原料5项,制剂2项),也是同类药品中第一批通过一致性评价的药品。
1.药品等效
润众®与原研恩替卡韦片(BARACLUDE®,Bristol-Myers Squibb Company)简明信息对比见表1。

1.1有关物质
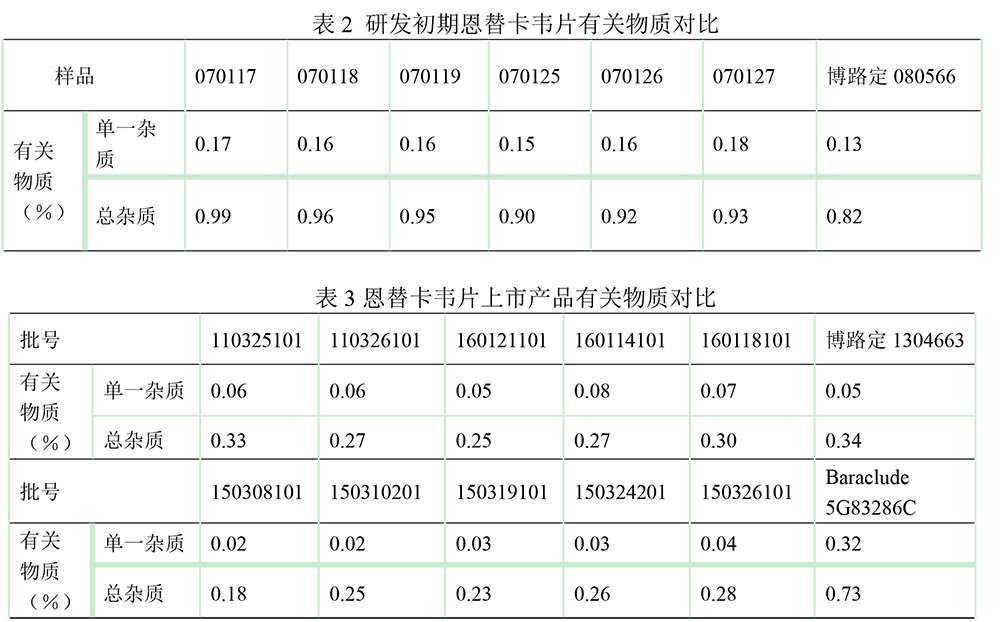
对研发初期润众®的6个批次的样品与博路定®进行有关物质对比(见表2),以及上市后5个批次分别与博路定®和Baraclude®的有关物质进行对比(见表3),润众®与原研片的最大单杂含量及总杂含量均符合恩替卡韦片的国家质量标准中有关物质限度要求。其中润众®在控制有关物质的方面具有优势,且批间差异小。
1.2溶出度
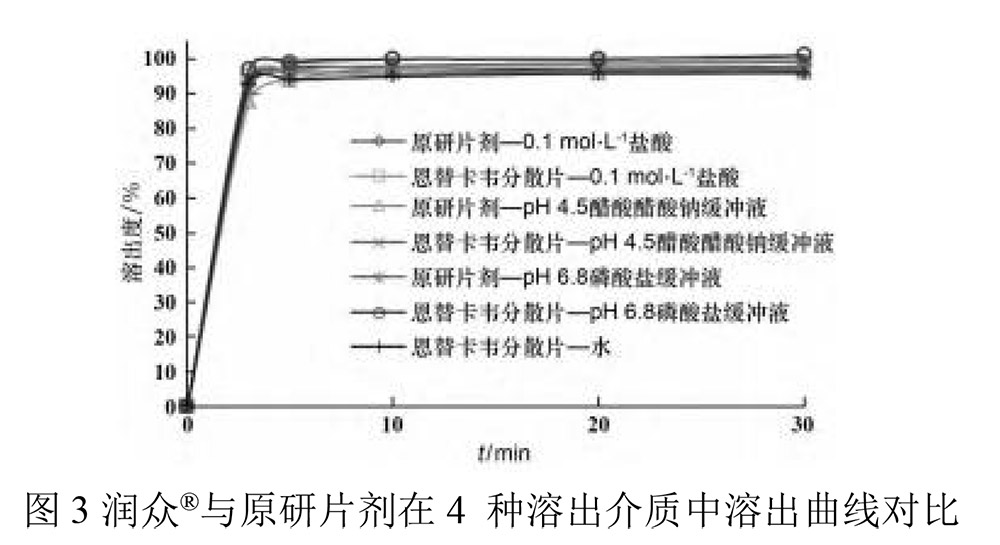
溶出度是固体制剂在规定溶剂中溶出的速度和程度,与体内生物利用度密切相关,是评价难溶性药物制剂内在质量的重要指标。参照《中华人民共和国药典》2010年版二部附录第二法(浆法)进行溶出度测定。以恩替卡韦分散片(润众,批号:140215101)和原研片(批号:1304663)在不同溶出介质中溶出曲线对比(图3),溶出曲线结果对比显示两者基本一致[8]。
2.生物等效性
润众®以原研片剂(博路定®,每片0.5 mg)为参比制剂进行了人体相对生物等效性试验。根据测得的恩替卡韦血浆浓度的经时曲线见图4,按面积法AUC估算其平均相对生物利用度单剂量时为107.5±24.7%。结果显示,润众®与市售原研片剂生物等效,两者在质量方面无显著性差异[9]。
3.临床等效性
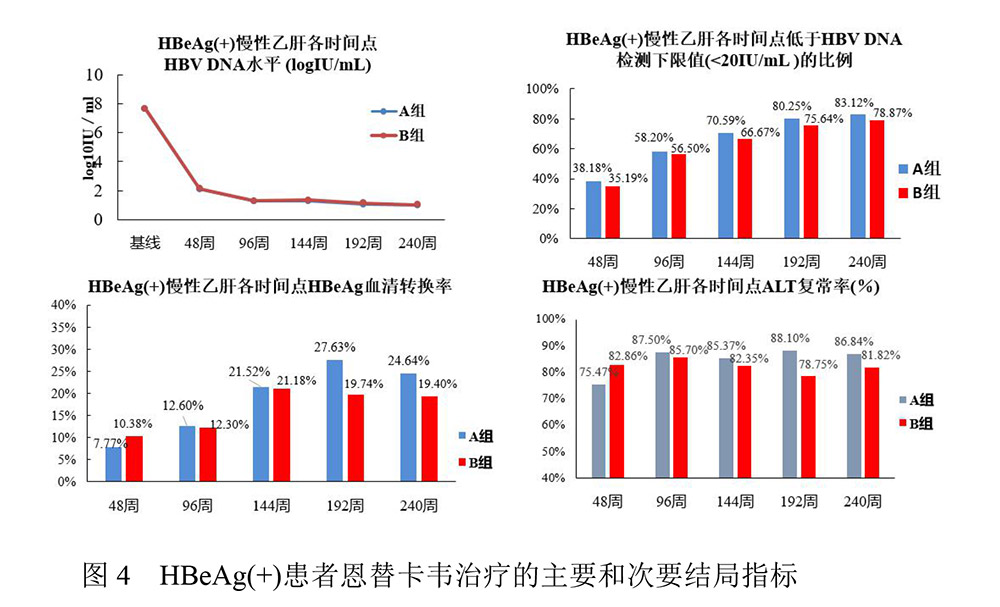
由北京大学第一医院牵头,国内10家医院参与的随机、双盲、阳性对照、多中心临床试验比较马来酸恩替卡韦片(天丁®,正大天晴药业集团股份有限公司)0.5g/d qd和恩替卡韦片(中美上海施贵宝制药有限公司)0.5g qd治疗慢性乙肝患者的有效性。两组结果表明: 对于HBeAg(+)及HBeAg(-)的患者,应用治疗48周、96周、144周HBV DNA的下降值、HBV DNA <300拷贝·mL-1比率、ALT复常率以及e抗原血清学转换率方面,马来酸恩替卡韦片与进口恩替卡韦疗效指标均一致,并且上市6年无严重不良反应发生,与进口恩替卡韦无显著性差异[10-12]。HBeAg(+)患者的主要和次要结局指标见图4。
积极鼓励并推进仿制药的研究开发与上市,是世界各国降低医疗成本、提高卫生保健水平的重要手段之一。在过去的几十年里,我国仿制药的研发与生产为满足国民用药需求做出了巨大的贡献。然而,为了让患者用好药,提高药品的品质需要企业对生产工艺与处方进行深入研究,需要政府、药品监管部门出台相应政策和标准,加强监管过程,保证药品的质量和规范药品市场,实现药品高水平发展的良性循环。近日,正大天晴恩替卡韦预中选国家 “4+7”药品集中采购,降价幅度达90%。带量采购落实后,能够为患者持续提供质量可靠且价格更低廉的药品,对广大乙肝患者来说是重大利好。
[1]李新刚,赵志刚. 从临床疗效角度谈原研药和仿制药的区别. 药品评价. 2013. (12): 8-12+21.
[2]郁庆华.我国仿制药与原研药的一致性评价. 上海医药. 2013. (5): 35-37.
[3]McCormack J, Chmelicek JT. Generic versus brand name: the other drug war. Can Fam Physician. 2014. 60(10): 911.
[4]冯毅,朱波. 关于我国仿制药质量一致性评价的研究及建议. 中国新药杂志. 2016. (01): 19-26+41.
[5]Food and Drug Administration Center for Drug Evaluation and Research Office of Medical Products and Tobacco Office of Generic Drugs, Approved drug products with therapeutic equivalence evaluation[EB /OL].[ 2018-12-01]
[6]Guidelines for the Prevention, Care and Treatment of Persons with Chronic Hepatitis B Infection. 2015. Geneva. World Health Organization.
[7]中华医学会肝病学分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015更新版). 中华肝脏病杂志. 2015. 23(12): 888-905.
[8]丁杨,丁宇, 董伦, 周建平. 恩替卡韦片剂的质量比较研究. 中国药学杂志. 2015. (01): 58-62.
[9]丁莹,宋敏, 史香龄等. 恩替卡韦分散片的健康人体相对生物利用度及生物等效性研究. 中国新药杂志. 2010. (07): 590-594.
[10]徐京杭, 于岩岩, 斯崇文等. 马来酸恩替卡韦片治疗HBeAg阳性慢性乙型肝炎的随机、双盲、双模拟、阳性药对照、多中心临床研究48周结果. 中华肝脏病杂志. 2013. 21(12): 881-885.
[11]徐京杭, 于岩岩, 斯崇文等. 马来酸恩替卡韦片治疗HBeAg阴性慢性乙型肝炎的随机、双盲、双模拟对照、多中心临床研究48周结果. 中华肝脏病杂志. 2012. 20(7): 512-516.
[12]徐京杭, 于岩岩, 斯崇文等. 马来酸恩替卡韦治疗慢性乙型肝炎的随机、双盲、双模拟对照、多中心临床研究96周结果. 中华传染病杂志. 2014. 32(10): 594-600.

李慧博
北京大学第三医院药剂科,主管药师,消化科专业及妇产科专业临床药师。擅长循证药学、卫生技术评估、治疗药物监测等。参与完成《“十二五”国家科技支撑计划药品综合评价》、《人感染禽流感及流感诊疗和防控原则》等项目以及《万古霉素治疗药物监测指南》、《肝硬化腹水及相关并发症的诊疗指南》、《严重产后出血指南》等指南的制订,参与编译马丁代尔药物大典37版。发表多篇核心期刊及SCI文章,参与申请专利1项。